摘要
歐盟MDR(Medical Devices Regulation)法規擴大與更新歐盟境內醫療器材的管控方式,整合舊有MDD醫療器材法(93/42/EEC)與AIMDD主動植入式醫療器材法(90/83/EEC)。
背景
歐盟MDR(Medical Devices Regulation)法規取代舊有的MDD(Medical Devices Directive)醫療器材法(93/42/EEC)與AIMDD(Active Implantable Medical Devices Directive)主動植入式醫療器材法(90/83/EEC),歐盟MDR法規擴大與更新歐盟境內醫療器材的管控方式。
時間線
- 2017年5月25日 生效
- 2021年5月26日 強制實施
- 2022年5月27日 MDD/AIMDD附錄四證書失效
- 2024年5月27日 所有MDD/AIMDD證書失效
法源
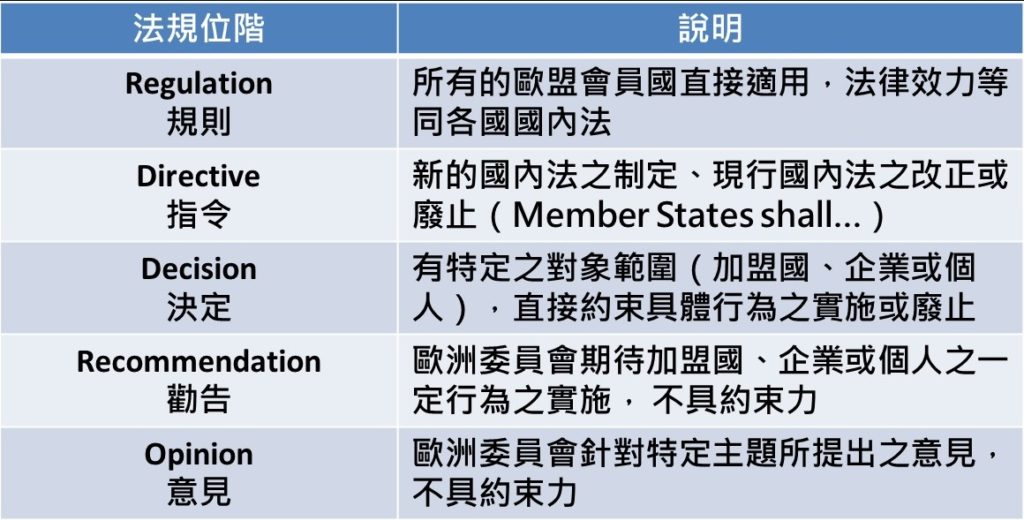
(EU) 2017/745,歐盟MDR(Medical Devices Regulation)的法規位階皆為「Regulation」,具最高執行力與強制力。
管控類型與範圍
- 非侵入式醫療器材 Rule 1 – Rule 4
- 侵入式醫療器材 Rule 5 – Rule 8
- 主動式醫療器材 Rule 9 – Rule 13
- 特殊規則 Rule 14 – Rule 22
注意:部份沒有醫療用途的產品、清潔、滅菌的醫材、美妝用途裝置等亦受歐盟MSR管控
醫療器材UDI條碼:
全名為醫療器材單一識別(Unique Device Identification)的UDI條碼需出現醫療器材或其包裝上,UDI條碼如同醫療器材的身份證一樣,能提高醫療器材在市場上的監管效率,當發生事故時,UDI亦能協助產品回收(Recall)。
歐盟醫療器材資料庫(EUDAMED)
EUDAMED(European Database on Medical Device)資料庫的成立,可讓資訊更加透明化,像是周期安全報告(PSUR)或UDI條碼資訊、事故等都可以在資料庫被查到。廠商需要定期追溯及監控整個醫療器材的生命周期,若有潛在風險必須修正與更新。
醫療器材的後市場監督(補上後市場監督與CE Mark)
CE標誌為醫療器材進入歐盟市場的基礎要求,亦是行之已年的後市場監督規範。貼上CE標誌的產品代表已完成相關法規要求,並有相對應的符合性聲明文件Declaration of Conformity(DoC)供稽查機關審查。
7月16日後《歐盟MSR市場監督條例, (EU) 2019/1020》正式啟用,於歐盟市場販售的醫療器材除了CE標誌,亦需特別留意新的後市場規範《歐盟MSR市場監督條例, (EU) 2019/1020》。
能邁歐盟MDR(Medical Devices Regulation)服務
- 歐盟MDR合規策略諮詢
- UDI(Unique Device Identification)條碼
- 技術文件評估/數據缺口/臨床證據
- 上市後合規技術支援
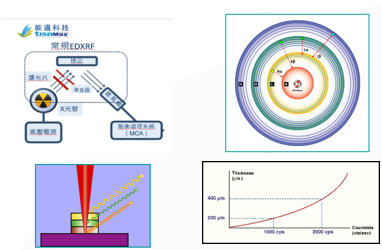
- CE標誌中,RoHS指令的快篩檢測設備
- 後市場監督的歐盟對應窗口
服務專員:黛小姐
- Tel : 02-8990-3188
- Mail: service@tisamax.com