廉價劣質原料藥於國際間流竄 導致多起原料藥汙染事件- 源頭管理(原料100%鑑別試驗)
- 中國假甘油製藥奪百命
- 歐美藥廠抗凝血劑致死及過敏事件質疑中國藥材品質衛生安全問題
- 藥企被曝膠囊鉻超標 是誰偷走了“良心藥”
- 陸惠康地溝油案牽連60企業 華英農業等4家上市公司深陷醜聞...
何謂PIC/s原料100%鑑別試驗? 是指在藥物在生產製造中,於風險控管上除了在生產製造做好品質管理外,還需要考量潛在可能風險,要求藥廠在原料進料時須對原料100%鑑別試驗
(100%逐批次 ID檢查),此為國際PIC/s的 原料100%鑑別試驗(100%逐批次 ID檢查)規範要求,包含API原料藥(Active Pharmaceutical Ingredients,API又稱活性藥物成份)與賦形劑。
台灣食藥署(TFDA)已在2018年6月正式加入ICH(International Council for Harmonisation), ICH組織的會員國已是全球用藥量佔約80%地區(國家)政府(US FDA、EU EMEA、JP MHLW)的國際組織。
從源頭做把關極為重要,因為藥是給人服用經不起一次出錯。所以在104年1月1日起,台灣製藥品質開始邁入國際(PIC/S cGMP,全名為Pharmaceutical Inspection Convention and Co-operation Scheme current Good Manufacture Practice) GMP(Good Manufacture Practice)的新紀元,所有西藥製劑製造工廠已全面升級,實施更加嚴謹的國際 PIC/S cGMP製藥標準,並推動藥廠所使用原料藥(API)品質的提升(優良製造規範:cGMP),落實源頭管制讓民眾用藥更安心,更放心。台灣食藥署(TFDA)也在2018年6月正式加入ICH, 而ICH組織的會員國已是全球用藥量佔約80%地區(國家)政府(US FDA、EU EMEA、JP MHLW)的國際組織,,勢必會加強PIC/s cGMP的審核稽查管理。
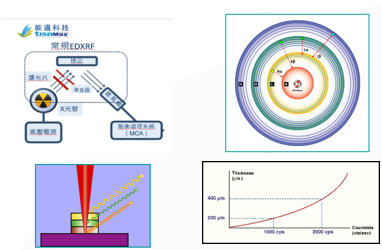
然而藥廠在API這一塊為了要確實原料100%鑑別試驗(100% 逐批次ID 檢查),往往必須砸下大量的人力及時間,現在市面上最新的技術- 空間偏轉拉曼(穿透式多變焦)光譜分析(Spatially Offset Raman Spectroscopy,以下簡稱SORS) ,可以輕鬆地解決這道難題!SORS可以在 不打開容器及包裝的情況下穿透不透明容器及包裝 ,數秒內快速準確地完成原料檢驗,無須透過費時費力的取樣機制。
法規機關(衛生福利部食品藥物管理署,TFDA)會強制規定針對醫藥進貨檢驗完成原料 100%鑑別試驗,且為了因應世界潮流,製藥品質的規範隨國際標準逐步提升,84年推動實施確效作業,96年再度推動實施國際GMP標準(PIC/S cGMP規範),過程中逐步淘汰
所以藥廠必需按照程序完成進貨檢驗,才能把這些原料用於醫藥製造流程,而最理想的地點就是倉庫,若從卡車卸貨後開始檢驗貨物並在檢驗合格後直接送上產線,將可大大節省人力及時間並減少打開藥物包才可能汙染或失效風險,SORS為一種全新原料檢驗方式,可直接在倉庫完成檢驗,不必打開包裝。
一般光譜在做原料100%鑑別試驗(100% 逐批次ID檢查)檢驗如果容器是 不透明的材質,會影響光譜法效能及準確性,因此必須在嚴格管制的取樣室內裁切容器或打開包裝,插入近紅外線範圍探針或開啟容器取出樣本,進一步執行紅外線分析/濕式測試,最後必須使用經過核准的密封籤重新密封容器,結束後取樣室也要經過徹底清潔,才能用於下一批貨物的測試作業,因為實施PIC/S cGMP除了要求製程避免交叉污染、防止混淆等生產與品質管制作業等嚴格控管外,對於無菌製劑產品或高致敏性、細胞毒類、女性荷爾蒙類等特殊產品之生產作業,也特別強調其風險控制,以保障消費者用藥安全。現階段藥廠一個完整的進料檢驗流程,可能需要 好幾個小時甚至是 好幾天才能確認進貨原料合格。